이용안내환자 중심의 의료서비스를
제공하는 우리들병원

이용안내환자 중심의 의료서비스를
제공하는 우리들병원

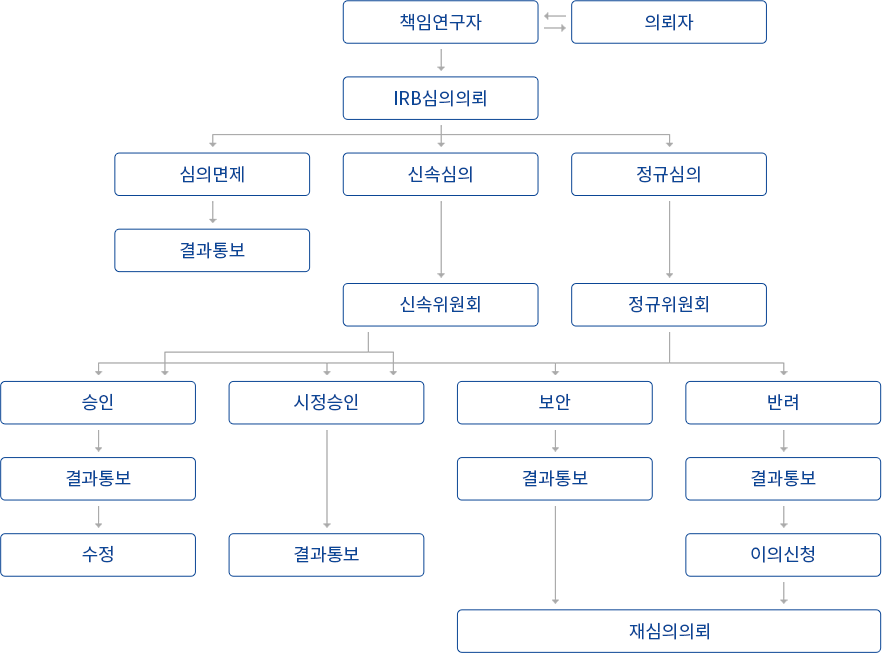
우리들병원 IRB 우리들병원 IRB(Institutional Review Board, 임상시험심사위원회)는 임상연구에 참여하는 대상자의 권리, 안전 복지를 위하여 인간을 대상으로 하는 연구의 윤리적 측면과 과학적 측면을 심의하는 독립된 합의제의결기구입니다.
본 IRB는 생명윤리 및 안전에 관한 법률에 따라서 연구계획에 대한 심의뿐만 아니라, 연구의 진행과정 및 결과에 대한 조사, 감독, 연구자 및 관련자의 연구윤리교육 등을 수행하는 의무를 가지고 있습니다.
| No. | 항목 | 임상시험 및 연구 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 의뢰자 주도임상 시험(SIT) | 의뢰자 주도임상 시험(IIT) | 관찰 연구 | 설문 조사 | 인체 유래물 연구(전항적) | 의무 기록 이용한 후향연구 | 시판후 사용 성적조사 | 심의 면제 | ||
| 1 | 연구계획 심의의뢰서 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 2 | 연구계획서 | ○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 3 | 심의면제 의뢰서 | △ | △ | △ | △ | △ | △ | × | ○ |
| 4 | 시험대상자 설명문 및 동의서 / 개인정보 활용 동의서 / 인체유래물 연구 동의서(해당시) |
○ | ○ | ○ | ○ | △ | × | ○ | × |
| 5 | 설명문 및 동의서 자가점검표(해당시) | ○ | ○ | ○ | ○ | △ | × | ○ | × |
| 6 | 시험대상자 동의면제 사유서 | △ | △ | △ | △ | △ | ○ | △ | × |
| 7 | 시험대상자 보상에 관한문서 (규약, 보험가입증 사본 등) |
○ | △ | △ | × | × | × | × | × |
| 8 | 증례기록서 | ○ | ○ | ○ | × | ○ | ○ | ○ | △ |
| 9 | 임상시험자 자료집 (시험약개요, 안전성 정보포함) |
○ | △ | △ | × | × | × | △ | × |
| 10 | 연구비 산정 내역서 | ○ | △ | △ | △ | △ | △ | ○ | △ |
| 11 | 제조(수입)품목 허가증사본 (식약처 허가조건 : 임상시험용) |
△ | △ | △ | × | ○ | × | ○ | × |
| 12 | 연구책임자 및 담당자이력서 및 GCP 교육이수증 |
○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 13 | 연구책임자 연구자 준수 서약서 및 이해상충서약서 |
○ | ○ | ○ | ○ | ○ | ○ | ○ | ○ |
| 14 | 식약처 또는 주관연구기관 승인서(해당시) | ○ | △ | △ | × | × | × | × | × |
| 15 | 시험대상사 모집 광고안(매체포함) | △ | △ | △ | △ | △ | × | △ | × |
| 16 | 설문지 | △ | △ | △ | ○ | △ | × | △ | × |
| 심사비 | 지속 심의 | 초기 심의 | |
|---|---|---|---|
| 의뢰자주도(SIT) 임상연구 | 1,000,000원 | 500,000원 | |
| PMS | 500,000원 | 300,000원 | |
| 연구자주도(IIT) 임상연구 | 1,000,000원 | 500,000원 | |
| 1) 연구비 있는 경우 (Sponsor/CRO, 국책과제, 후향적) |
1억원 이상 | 500,000원 | 300,000원 |
| 2) 연구비 없는 경우 (현물만 제공. ex)약물, 의료기기) |
3,000만원 이상 | 300,000원 | 165,000원 |
| 내부과제 연구자 주도(연구비 없는 경우) |
3,000만원 미만 | 해당 없음 | 해당 없음 |
| 외부과제 (연구책임자의 소속이 청담 우리들병원이 아닌 경우) |
500,000원 | 300,000원 | |
※ 담당자 : 이윤선 행정간사, Tel. 02)-513-8147, E-mail: lys14@wooridul.co.kr
이용 안내
모니터링실 신청
이용 주의사항